Исследователи повысили эффективность первичного редактирования, универсальной технологии редактирования генов, основанной на CRISPR, и использовали улучшенную систему для исправления патологических мутаций в клетках.
Ученые разработали набор молекулярных инструментов, которые повышают эффективность технологии редактирования генов, называемой первичным редактированием, для различных типов клеток и генов-мишеней, расширяя терапевтические и исследовательские возможности этой технологии. В двух новых исследованиях исследователи использовали улучшенные системы первичного редактирования для исправления мутаций, связанных с несколькими нейродегенеративными, метаболическими и сердечно-сосудистыми заболеваниями.
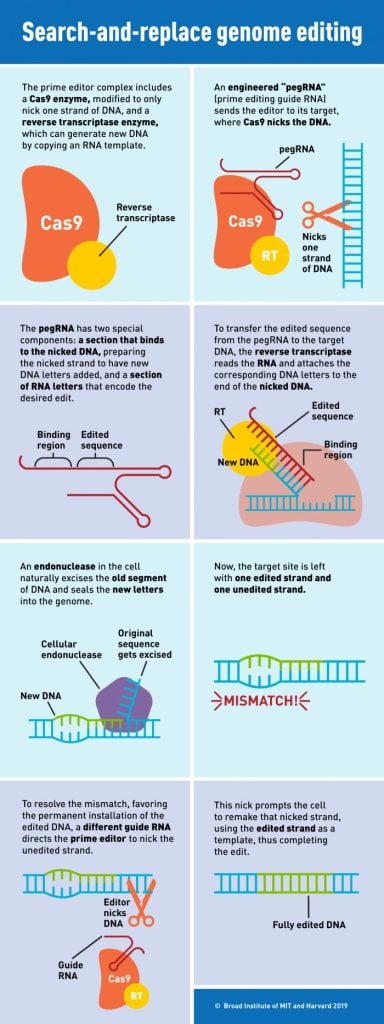
Впервые он был описан в 2019 г.Первичное редактирование — это точный метод редактирования генов, который может исправить подавляющее большинство известных генетических вариаций, вызывающих болезни. Исследователи могут использовать начальное редактирование для работы. ДНК Замены, вставки и делеции в сайтах-мишенях в клетках человека и животных. Однако эффективность редактирования зависит от типа редактируемой клетки и целевого сайта в геноме.
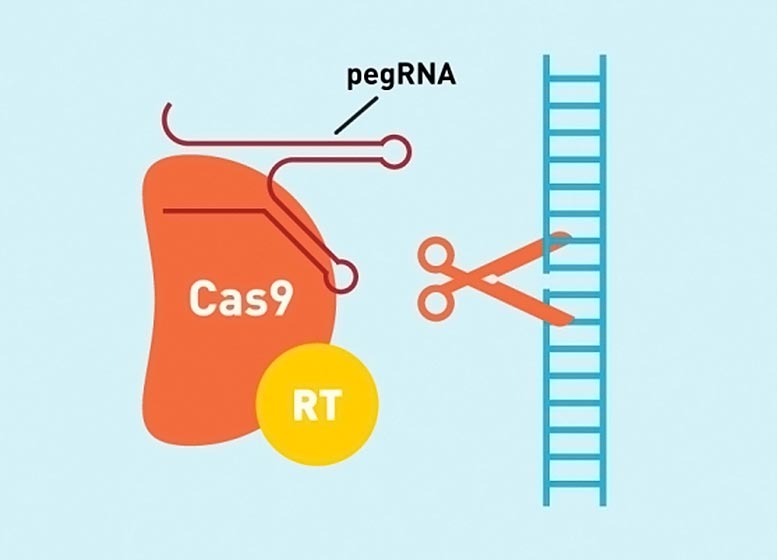
Для дальнейшего развития технологий ученые из Института Броуда с участием Гарвард — это усовершенствование ключевого компонента базовой системы редактирования, называемой РНК, управляемой редактированием, или «pegRNA», которая кодирует предполагаемую модификацию и управляет механизмом первоначального редактирования. В исследовании, недавно опубликованном в биотехнология природы, исследователи показали, что пегРНК могут деградировать в клетках, отсекая пегРНК, которые мешают начальному редактированию. Они разработали новые пегРНК, защищенные от деградации в клетках, что повысило эффективность крупномасштабного редактирования.
Во втором исследовании, недавно опубликованном в клеткаОбширные исследователи, сотрудничающие с учеными в Университет Принстона и Калифорнийский университет в Сан-Франциско (UCSF) определили клеточные пути, ограничивающие эффективность первичного редактирования, и использовали эти идеи для разработки следующего поколения систем первичного редактирования.
В обоих исследованиях исследователи показали, что новые системы могут более эффективно модифицировать связанные мутации. Болезнь Альцгеймера Сердечно-сосудистые заболевания, серповидноклеточная анемия, прионная болезнь, диабет 2 типа и другие заболевания с меньшим количеством побочных продуктов.
Дэвид Лю, ведущий автор обоих исследований, сказал профессор Ричарда Меркина и директор Института Меркина по трансформационным технологиям в здравоохранении в Институте Броуда, профессор Гарвардского университета и исследователь в Медицинском институте Говарда Хьюза.
Более стабильное руководство по проектированию
Первоначальное редактирование позволяет ученым исправить подавляющее большинство известных болезнетворных мутаций — включая замены, вставки или делеции до десятков пар оснований — в определенных местах генома. В отличие от некоторых других методов редактирования генома, первичное редактирование не предполагает разрезания обеих цепей ДНК и, как результат, снижает вероятность нежелательных результатов редактирования или нежелательных клеточных реакций. (См. Диаграмму выше для получения дополнительной информации о том, как работает первичное редактирование.) Сотни исследовательских групп сейчас используют первичное редактирование для изучения и исправления мутаций у самых разных организмов, включая рис, пшеницу, рыбок данио и мышей.
Впервые описав первоначальное редактирование в 2019 году, команда Лю продолжила разработку технологии. в биотехнология природы В ходе исследования они обнаружили уязвимость в пегРНК, которая снижает эффективность. Они обнаружили, что длинная цепочка РНК В конце pegRNA, кодирующая модификацию, подвергалась деградации под действием клеточных ферментов. Деградированные пегРНК не могут опосредовать начальное редактирование, а также «отравить» первичную систему редактирования, блокируя доступ к целевым сайтам интактными пегРНК.
Затем исследователи искали защитные структуры, которые они могли бы добавить к пегРНК. Они протестировали несколько различных последовательностей РНК, выявив те, которые складываются в узловые структуры, защищающие их от ферментов, разрушающих РНК. Когда они модифицировали pegRNAs, чтобы включить узлы и контактные последовательности, они наблюдали значительное увеличение начальной эффективности редактирования, указывая на то, что новые структуры сохранили шаблон РНК для редактирования.
Используя сконструированные pegRNA, или epegRNA, в группе линий клеток млекопитающих, исследователи увидели, что epegRNA увеличивают эффективность первоначального редактирования в среднем в три-четыре раза, с большим улучшением клеточных линий, в которых первоначальное редактирование ранее было труднее.
Ориентация ячейки на начальные правки
в клетка В ходе исследования команда Лю и его сотрудники разработали белковый компонент первичной системы редактирования, чтобы повысить эффективность и уменьшить количество побочных продуктов, образующихся в широком диапазоне типов клеток, включая клетки пациентов.
Исследователи стремятся более полно понять клеточные факторы, определяющие исходные результаты редактирования, чтобы они могли создавать более эффективные системы. Команда подозревала, что некоторые клеточные белки, которые активны во время ключевой части процесса первичного редактирования — когда клетка восстанавливает молекулы ДНК, созданные главными редакторами, — могут препятствовать или даже обращать вспять модификацию и увеличивать производство нежелательных побочных продуктов. Чтобы проверить эту гипотезу, исследователи сотрудничали с группами под руководством Бретта Адамсона, доцента Принстонского университета. и Джонатан Уайзман, профессор UCSF, когда началось исследование, а теперь профессор Массачусетского технологического института, член Института Уайтхеда и исследователь Медицинского института Говарда Хьюза. Используя CRISPR-экраны на основе интерференции, команды систематически исследовали эффект отключения каждого из 476 различных генов репарации ДНК при первоначальном редактировании.
Основываясь на этих выводах, исследователи сосредоточились на процессе, называемом репарацией несоответствия, который происходит в клетках естественным образом, чтобы исправить несоответствия ДНК, возникающие во время репликации и восстановления ДНК. Они обнаружили, что устранение несоответствий мешает первоначальному редактированию, снижает эффективность редактирования и увеличивает долю непреднамеренных вставок или удалений.
Вооружившись этим пониманием, команда разработала новые системы первичного редактирования, которые они назвали PE4 и PE5, которые включают белок MLH1dn, который исследователи разработали для временной блокировки компонента восстановления несоответствия. В клетках, где происходит восстановление несоответствия, исследователи обнаружили, что PE4 и PE5 значительно повышают эффективность редактирования и производят значительно меньше побочных продуктов по сравнению с текущими системами первичного редактирования.
Наконец, ученые создали PEmax с улучшенной архитектурой и аминокислотами. кислый Последовательность первичного монтажа машин. Комбинация улучшений систем PE4, PE5, PEmax и epegRNAs привела к 10-100-кратному увеличению эффективности редактирования по сравнению с существующими системами.
«Объединив опыт различных исследовательских групп, мы смогли узнать, как работало первоначальное редактирование, и улучшить отдельные части системы», — сказал Адамсон. «Это исследование является прекрасным примером того, как базовое понимание может управлять экспериментальным дизайном».
к исцелению
По словам Лю, во многих случаях совместные улучшения epegRNA и PE4 / 5 / max облегчают ученым создание клеточных моделей болезни, что является важным шагом на пути к разработке методов лечения.
В настоящее время команда использует эти системы для лечения генетических заболеваний на клеточных и животных моделях и продолжит изучение базовой биологии этих систем.
«Все эти инновации носят синергетический характер», — сказал Лю. «Благодаря этим улучшениям мы смогли эффективно и чисто модифицировать важные типы клеток, которые однажды могут помочь пациентам с заболеваниями с генетическим компонентом. Эти результаты также предполагают, что существуют другие стратегии, которые могут еще больше улучшить первоначальное редактирование».
Использованная литература:
«Улучшенные первичные системы редактирования путем манипулирования клеточными детерминантами для изменения результатов» Питера Дж. Чена, Джеффри А. Хаусмана, Джона Яна, Фредерика Ниппинга, Пурнима Равизанкар, Бен Фанг Чен, Сиди Чен, Джеймса У. Нельсона, Грегори А. , Мостафа Шахин, Марк Дж. Осборн, Джонатан С. Вайсман, Бретт Адамсон и Дэвид Р. Лео, 14 октября 2021 г., клетка.
DOI: 10.1016 / j.cell.2021.09.018
«Сконструированные пегРНК повышают эффективность первоначального редактирования» Джеймс У. Нельсон, Пейтон Б. Рэндольф, Саймон Б. Шин, Келси А. Эверетт, Питер Дж. Чен, Эндрю Ф. Чен, Элвин Сю и Дэвид Р. Лю, 4 октября 2021 г., доступно здесь. биотехнология природы.
DOI: 10.1038 / s41587-021-01039-7
Эта работа была поддержана Институтом трансформирующих технологий в здравоохранении Меркина, Национальными институтами здравоохранения, Медицинским институтом Говарда Хьюза, Фондом Лулу и Фондом Билла и Мелинды Гейтс.

«Главный евангелист пива. Первопроходец в области кофе на протяжении всей жизни. Сертифицированный защитник Твиттера. Интернетоголик. Практикующий путешественник».


:quality(70):focal(641x410:651x420)/cloudfront-eu-central-1.images.arcpublishing.com/irishtimes/QEZ2CGFKWYFNRZWR4CQJA7PQRQ.jpg)


More Stories
Сообщество регби сплачивается за талантливого игрока после «разрушительного» диагноза.
Огромное доисторическое морское чудовище ростом выше двух автобусов было обнаружено после того, как 11-летняя британская девочка нашла окаменелости на пляже Сомерсет.
Пациент-ориентированная интегративная и альтернативная терапия в неврологии: Кэролин Бернштейн, доктор медицинских наук