ML был связан с прогнозом пациентов с OS
В нашем исследовании алгоритм анти-MCP, а также одномерный и одномерный регрессионный анализ Кокса были выполнены для идентификации иммунных клеток, связанных с выживанием. Результаты одномерного регрессионного анализа Кокса показали, что ML представляет собой иммунную клетку, связанную с выживаемостью пациентов с ОС (рис. 1А). Кроме того, анализ Каплана-Мейера показал, что низкий уровень ML был связан с плохим прогнозом для пациентов с OS (p = 0,033, рисунок 1b).
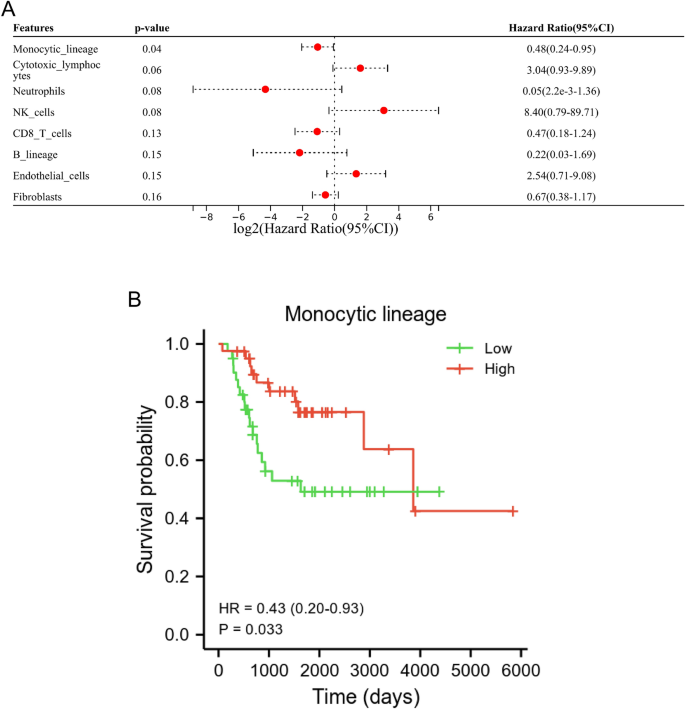
МЛ ассоциировалась с плохим прогнозом у пациентов с ОС. (а) Одномерный анализ Кокса шести иммунных клеток и двух стромальных клеток на основе базы данных TARGET. (Б) Анализ Каплана-Мейера показал, что уровень ML был значимо связан с прогнозом у пациентов.
Анализ ДЭГ и потенциальных сигнальных путей между двумя подгруппами
Всего после анализа ДЭГ было идентифицировано 435 ДЭГ (рис. 2А, Б). По сравнению с LML, в группе HML наблюдалась активация 101 гена и 334 генов. В термине «биологические процессы» (БП) эти ДЭГ участвуют в регуляции активации лимфоцитов, активации Т-клеток, позитивной регуляции активации Т-клеток, регуляции активации Т-клеток, адгезии лейкоцитов и т. д. Что касается клеточных компонентов (КК), ДЭГ были вовлечены во внешнюю сторону плазматической мембраны, мембрану секреторных гранул, гранулы, богатые фиколином-1, иммунный синапс, НАДФН-оксидазный комплекс и так далее. Что касается молекулярных функций (MF), DEG были значительно обогащены связыванием углеводов, связыванием рецепторов цитокинов, связыванием цитокинов, активностью рецепторов цитокинов, активностью рецепторов цитокинов CC и т. Д. В термине KEGG DEG в основном были обогащены линией гемопоэтических клеток, остеогенной дифференцировкой, взаимодействием цитокинов и цитокиновых рецепторов, сигнальным путем рецептора B-клеток и т. д. (рис. 3).
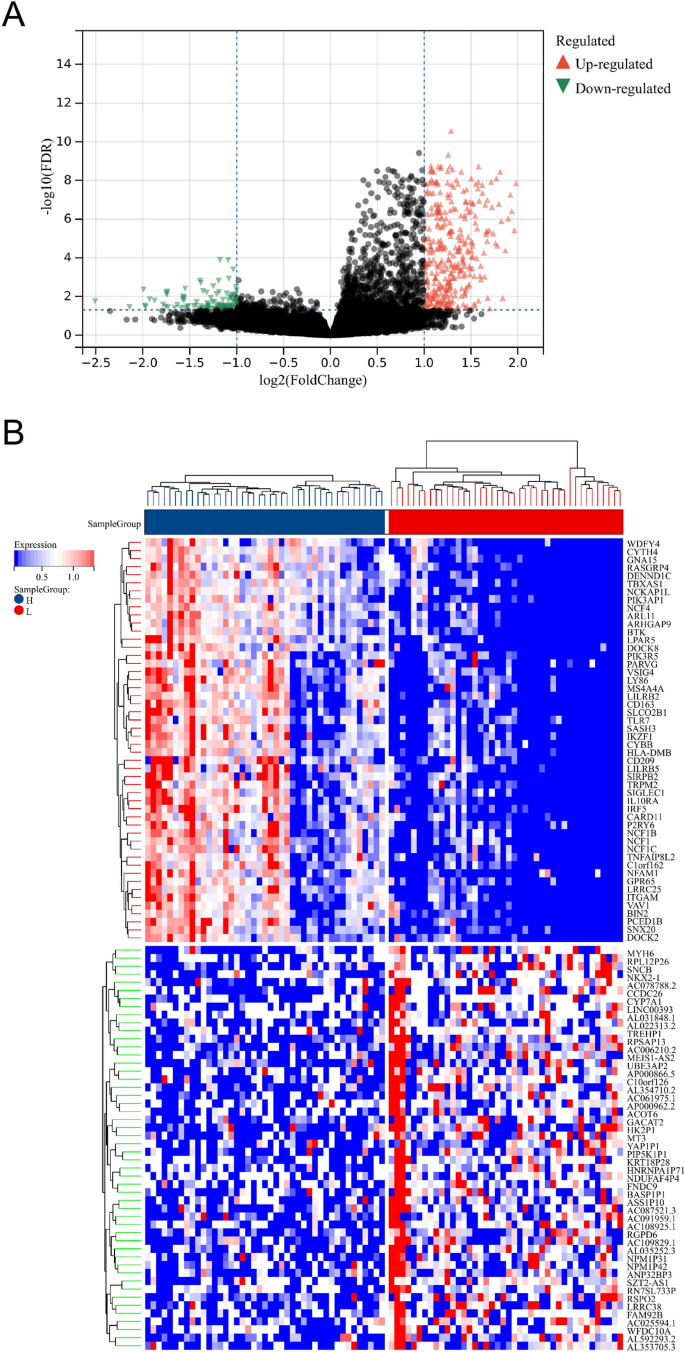
Идентификация DEG между подгруппами LML и HML. (а) График вулкана, изображающий DEG между подгруппами LML и HML. Зеленые точки представляют гены с пониженной регуляцией, а красные точки представляют гены с повышенной регуляцией. (Б) На графике тепловой карты показаны 50 лучших результатов между подгруппами LML и HML.
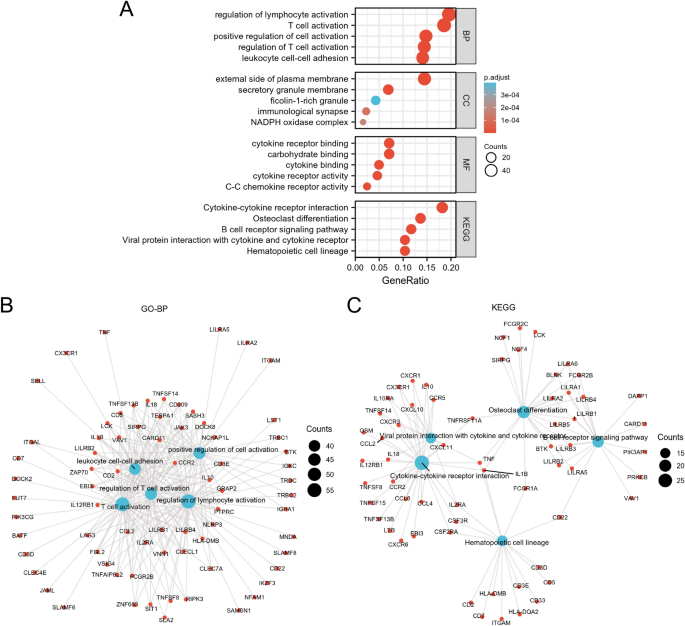
Анализ обогащения ДЭГ. (а) Пузырьковые диаграммы отображали результаты GO и KEGG. На сетевой диаграмме изображены термины GO-BP, связанные с иммунитетом и воспалением (Б) и пути KEGG (С). Синие узлы представляют собой термины путей GO-BP или KEGG, а красные узлы представляют гены, участвующие в этих путях.
Инфильтрация иммунных клеток
Мы проанализировали иммунный статус между подгруппами LML и HML, чтобы расшифровать иммунное микроокружение при ОС. Как показано на рисунке 4А, по сравнению с группой HML, показатель стромы, иммунный показатель и градационный балл снизились в группе LML (с<0,01), в то время как чистота опухоли была значительно увеличена в группе LML (с<0,01). По сравнению с группой HML, уровни эндотелиальных клеток, миелоидных дендритных клеток, линии моноцитов, линии B, Т-клеток и Т-клеток CD8 были значительно снижены в группе LML (с<0,05) (рис. 4б).
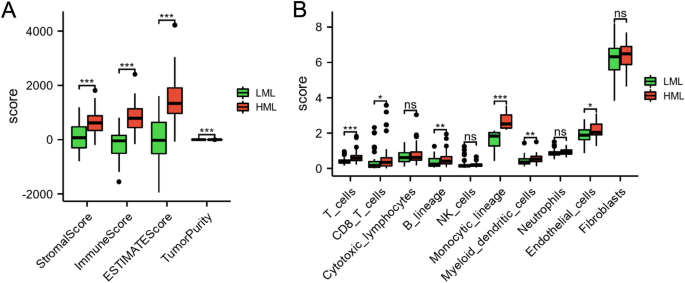
Просмотр уровней инфильтрации иммунных клеток в двух подгруппах. (а) Сравнение стромальной оценки, иммунологической оценки, расчетной оценки и чистоты опухоли между подгруппами LML и HML. (Б) Сравнение уровней инфильтрации иммунных клеток между подгруппами LML и HML. *с< 0,05, **с<0,01 и ***с<0,001.
Построение и оценка модели прогностического риска
После одномерного регрессионного анализа Кокса мы исследовали 122 гена, связанных с выживанием (таблица S1). Затем регрессионный анализ Кокса LASSO выявил восемь генов (CCDC26, TERT, GJA5, KRT18P28, LILRA6, PDE1B, CD180 и IL2RA) для многомерного регрессионного анализа Кокса (рис. 5A, B). Наконец, три важных гена, связанных с выживанием (TERT, IL2RA и CCDC26), были исследованы и использованы для создания прогностической модели (рис. 5C).
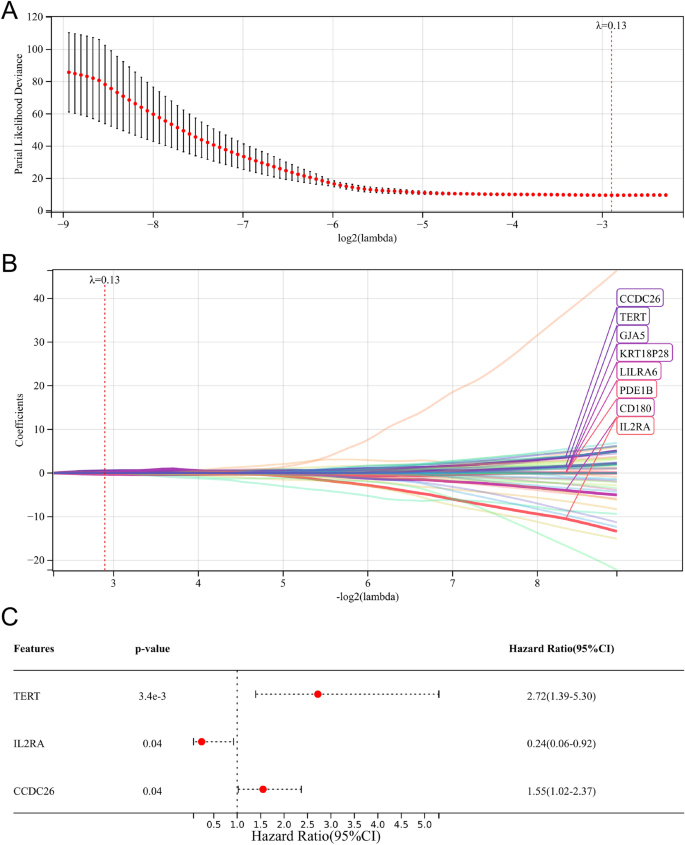
Создайте прогностическую модель, связанную с ML. (а, Б) Лассо-регрессионный анализ. (С) Многомерный регрессионный анализ Кокса.
В наборе данных TARGET уровень экспрессии TERT и CCDC26 был снижен в группе низкого риска, тогда как экспрессия IL2RA была снижена в группе низкого риска. Более того, в группе высокого риска доля выживших была ниже (рис. 6А). У пациентов с ОС в группе низкого риска общая выживаемость была выше, чем у пациентов из группы высокого риска (рис. 6B, с<0,001). AUC этой прогностической модели составила 0,8 через 1 год, 0,87 через 3 года и 0,85 через 5 лет (рис. 6C), и этот результат показал, что прогностическая модель имела хорошие диагностические характеристики для пациентов с ОС. Мы также использовали набор данных GSE21257 для проверки диагноза и прогностических особенностей модели риска. Как показано на рисунке 7A, уровень экспрессии TERT и CCDC26 был снижен в группе низкого риска, тогда как экспрессия IL2RA была снижена в группе низкого риска. Кроме того, в группе риска была меньшая доля выживших. Пациенты с ОС в группе низкого риска показали более высокую общую выживаемость, чем пациенты в группе высокого риска (с= 0,025) (рис. 7б). AUC для этой прогностической модели составляла 0,84 через 1 год, 0,67 через 3 года и 0,68 через 5 лет (рис. 7C). Эти результаты соответствовали результатам набора данных TARGET.
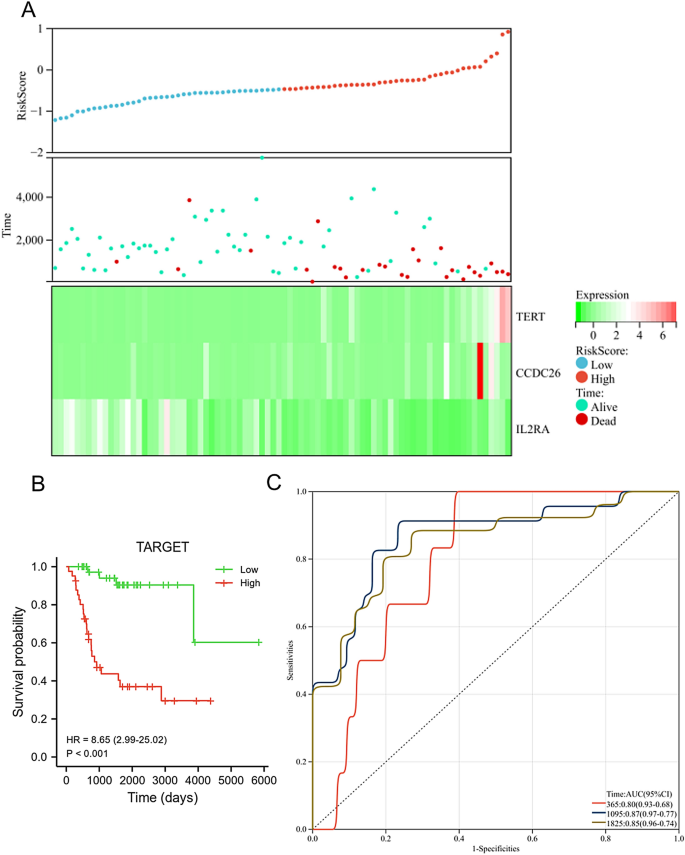
Оценка прогностической модели в базе данных TARGET. (а) Уровень экспрессии TERT, CCDC26 и IL2RA (внизу), статус выживаемости (средний) и распределение оценок риска между группами низкого и высокого риска (вверху). (Б) Анализ выживаемости показал разницу между группами низкого и высокого риска. (С) Анализ кривой ROC прогностической модели в зависимости от времени.
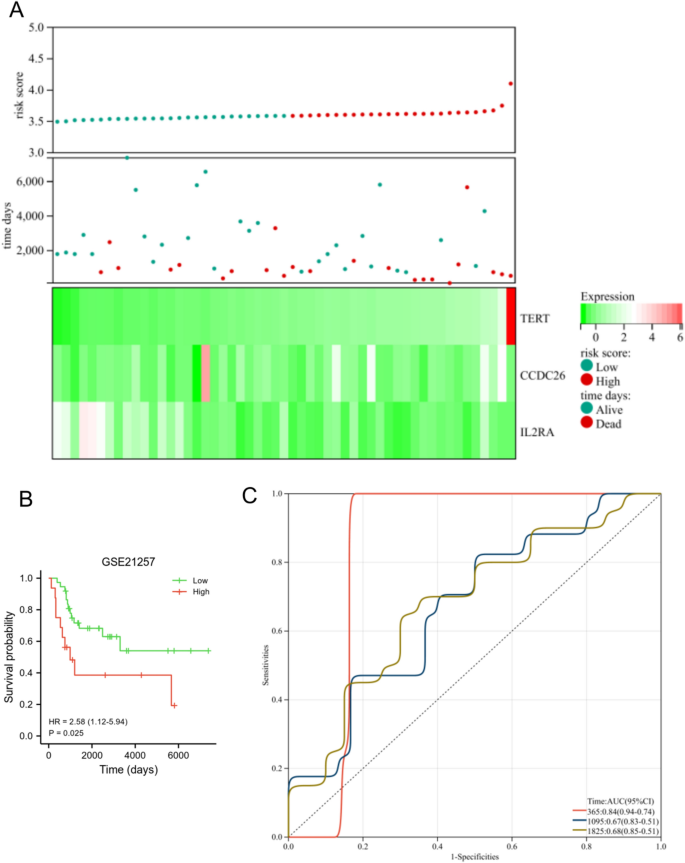
Проверка прогностической модели на наборе данных GSE21257. (а) Уровень экспрессии TERT, CCDC26 и IL2RA (внизу), статус выживаемости (средний) и распределение оценок риска между группами низкого и высокого риска (вверху). (Б) Анализ выживаемости показал разницу между группами низкого и высокого риска. (С) Анализ кривой ROC прогностической модели в зависимости от времени.
Кроме того, была создана номограмма для дальнейшего оказания помощи в прогнозировании прогноза пациентов с ОС (рис. 8А). Результаты прогнозирования номограммы полностью соответствовали наблюдаемым пациентам с ОС на основе калибровочной кривой номограммы (рис. 8b).
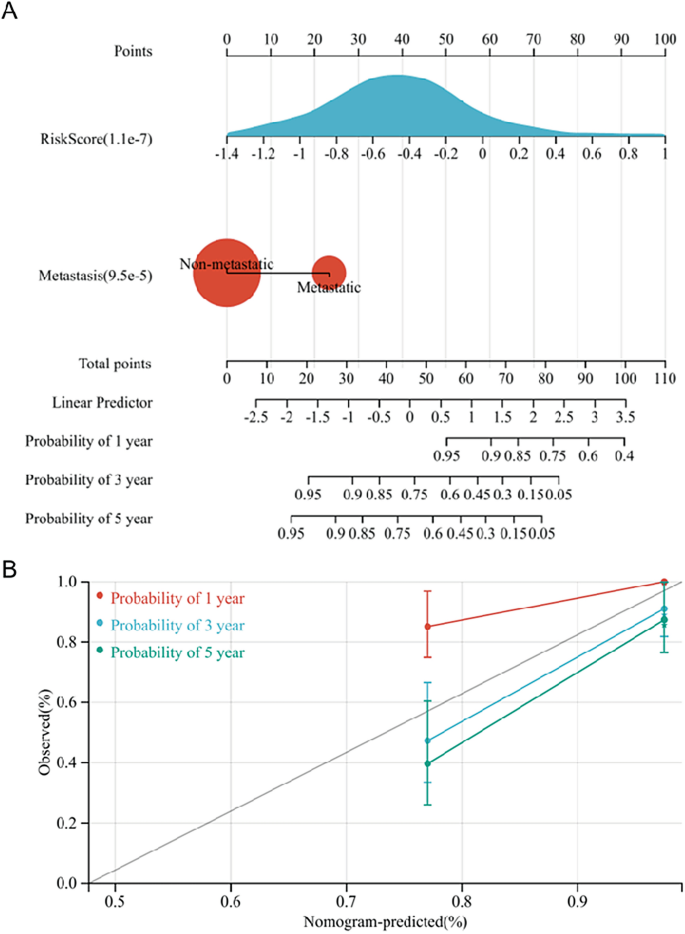
Создайте график. (а) Для создания номограммы использовались метастазы и оценка риска. (Б) График калибровочной кривой.
Анализ взаимодействия прогностических генов
Используя базу данных GeneMANIA, нам удалось построить сеть взаимодействия белков для сигнатурных генов (TERT и IL2RA). Благодаря этому анализу мы обнаружили в общей сложности 20 генов, которые взаимодействуют с сигнатурными генами (рис. 9А). Для этих 22 генов был проведен анализ функционального обогащения.Результаты, полученные в результате анализа обогащения, показали, что эти гены в основном связаны с регуляцией теломер, поддержанием теломер, инфицированием вирусом Т-клеточного лейкоза человека 1, дифференцировкой клеток Th1 и Th2 и т. д. (рис. 9Б).
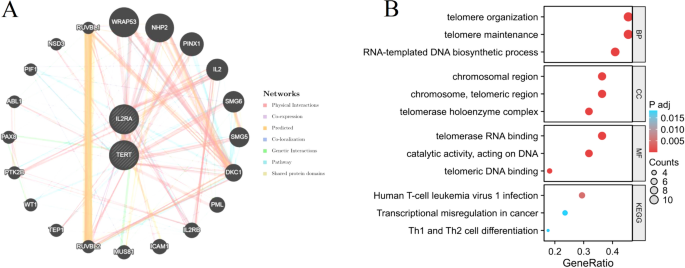
Анализ взаимодействия сигнатурных генов. (а) Сеть совместной экспрессии сигнатурных генов. (Б) Анализ функционального обогащения генов, экспрессируемых GO и KEGG.
Связь между генами, связанными с моделью риска, и микроокружением опухоли (ТМЕ)
Мы провели анализ уровня экспрессии генов TERT и IL2RA в клетках, ассоциированных с опухолевым микроокружением ОС, с использованием базы данных TISCH. Наши результаты показали, что IL2RA продемонстрировал более высокий уровень инфильтрации в клетках cDC1, моноцитах и клетках M2 (рис. 10).
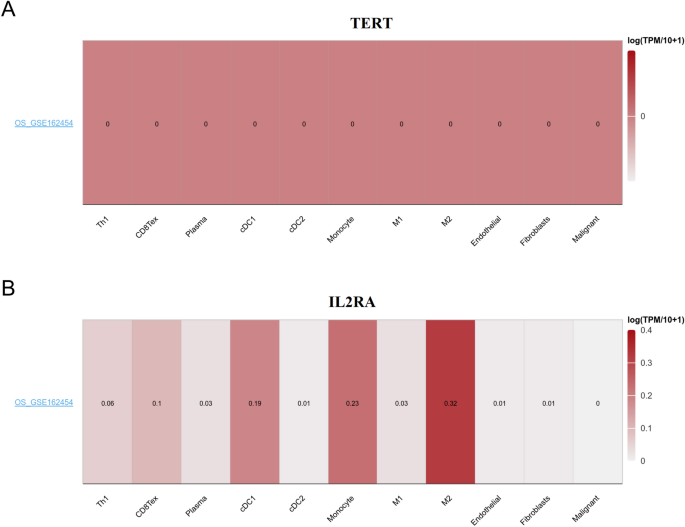
Гены, связанные с паттернами риска, были экспрессированы в клетках, соответствующих микроокружению опухоли. Уровни экспрессии TERT (а) и ИЛ2РА (Б) в ячейках, связанных с микроокружением ОС, с использованием тепловой карты в наборе данных GSE162454.
Прогностическая модель может различать пациентов с метастатической ОС.
Как показано на рисунке 11а, по сравнению с группой высокого риска (TARGET, 58,54% и GSE21257, 17,25%), в группе низкого риска не наблюдалось случаев метастазирования (TARGET, 90,25% и GSE21257, 58,34%). Более того, по сравнению с группой с метастатическими заболеваниями, показатель риска был ниже в группе без метастазов (с<0,01, рисунок 11б,в). Более того, результаты ROC-анализа показали, что диагностическая эффективность прогностической модели для прогнозирования метастазов составила 0,659 и 0,705 для TARGET и GSE21257 соответственно (рис. 11D,E). Эти результаты показали, что модель риска может предсказать злокачественное новообразование у пациентов с ОС.
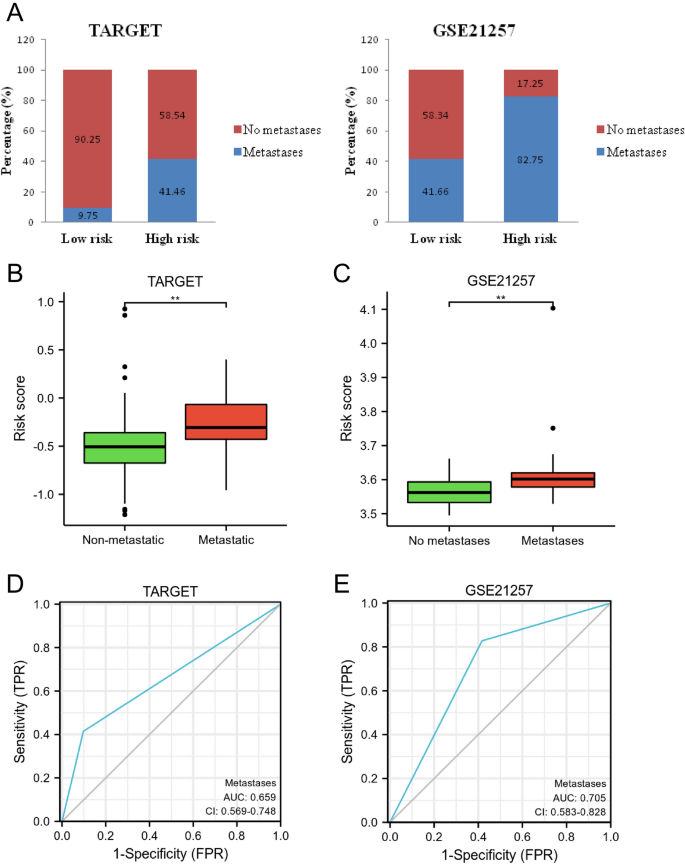
Оценить способность прогностической модели предсказывать злокачественное новообразование у пациентов с ОС. (а) Сравнение частоты метастазирования и отсутствия метастазов в группах низкого и высокого риска. (Б) Сравнение показателей риска в метастатических и неметастатических группах. (С) ROC-анализ диагностической эффективности при прогнозировании метастазов при ОС.

«Zombie amateur evangelist. Incurable creator. Proud twitter innovator. Food lover. Internetaholic. Rigid introvert.»






More Stories
Spotify обвиняет Apple в нежелательном изменении технологии регулировки громкости
Первый пациент Neuralink дал имя своему мозговому чипу и выучил новые языки
Meta рассматривает возможность выпуска новых очков смешанной реальности в качестве альтернативы гарнитурам