Моделируйте распределение температуры и тепловую дозу имплантата и окружающих тканей.
Для моделирования динамики распределения тепла внутри имплантата и окружающих тканей в цифровой форме моделировали прерывистый нагрев АМФ стального шарика, погруженного в среду, имитирующую свойства мышечной ткани (рис. 2). Моделирование было репрезентативным для типичных доз iAMF (либо 12 циклов нагрева до 65°C с 5-минутными интервалами, либо 1 цикл до 75°C), использованных в этом исследовании. Как видно на смоделированном поперечном сечении стального шара и тканевой среды (рис. 2а), при пиковой температуре имплантата примерно 65 °C значительное повышение температуры в окружающей тканеподобной среде оставалось в пределах 1 мм от сферы, даже после воздействия Мультиметр. На этапе охлаждения каждого цикла как стальной шар, так и окружающая среда возвращались к внутренней температуре (~32 °C) с минимальным повышением температуры в течение 60-минутной дозы (рис. 2b). Чтобы проверить согласованность моделирования с экспериментами iAMF in vivo, температуру стального шарика, хирургически имплантированного в мышцу ноги мыши, измеряли с помощью датчика, встроенного в шарик. Как показано на рисунке 2b, измерения (синие точки) перекрывали кривую моделирования (красная линия) с минимальным расхождением. Подгоняя части нарастания и спада смоделированных и измеренных температурных данных к кривым экспоненциального роста и затухания, R2 Степень соответствия во всех случаях превышала 0,97. Для сравнения на рисунке 2c показано моделирование одноимпульсного AMF при температуре 75 °C.
На основе моделирования динамического распределения температуры iAMF мы рассчитали термическую дозу, накопленную в объеме ткани на радиальных расстояниях от поверхности имплантата до ткани, на основе модели CEM43 (рис. 2d–e). По мере увеличения времени нагрева iAMF (или числа импульсов AMF) пределы 240 CEM43 (необратимое повреждение тканей) и 30 CEM43 (полностью обратимое повреждение тканей) увеличивались. Однако даже после 12 циклов AMF 240 и 30 CEM43 находились на расстоянии всего 0,57 мм и 0,35 мм от поверхности металлического имплантата соответственно, так что все ткани за пределами этих пределов не пострадали.
iAMF и антибиотики эффективны в уменьшении биопленок in vivo
После разработки и характеристики нагревательного воздействия iAMF были проведены эксперименты in vivo для сравнения его воздействия отдельно и в сочетании с антибиотиками на различные штаммы имплантатов, инфицированных биопленками. Один шарик из нержавеющей стали, с любым Стафилококкс ауреус или синегнойная палочка Биопленки имплантировали в мышцу ноги мышей и подвергали четырем последовательным дням обработки либо iAMF (без iAMF, без антибиотиков), либо однократным импульсом iAMF при 75°C, только антибиотиками, либо комбинацией iAMF-антибиотик, после чего их удаляли. оставшиеся биопленки КОЕ. Они определяются по извлеченным имплантатам (рис. 3). Бактерии золотистого стафилококка Пострадавшим мышам вводили плацебо iAMF, только iAMF, цефтриаксон (50 мг/кг) или комбинированное лечение, в то время как П. aeruginosa Пострадавшие группы получали плацебо iAMF, только iAMF, ципрофлоксацин (20 мг/кг) или комбинированную терапию.
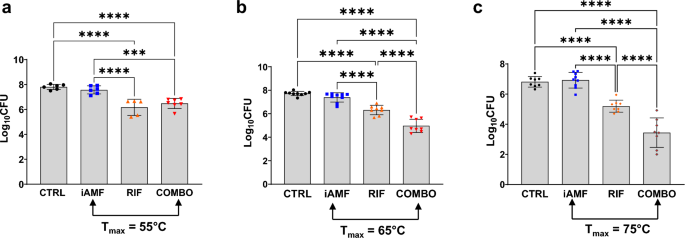
Уменьшение бактериальной записи биопленок (а) Грамположительные (С. ауреус) с цефтриаксоном [CRO] В (50 мг/кг) или (Б(грамотрицательный)П. aeruginosa) с ципрофлоксацином [CIP] (20 мг/кг) после одного цикла нагревания iAMF в сутки (Tвыше= 75°С; N = 8), антибиотики (ABX; N = 10) или комбинированная терапия iAMF∙ABX (iAMF∙ABX; N = 10) по сравнению с плацебо (без антибиотиков или iAMF; N = 11). Столбики ошибок указывают SD. Результаты были значительными в с = 0,0061 (**), 0,0004 (***) и <0,0001 (****) для конкретных сравнений, показанных с использованием однофакторного дисперсионного анализа с критерием множественных сравнений Тьюки. Средний журнал10КОЕ Начальное количество бактерий на некультивируемом шаре Бактерии золотистого стафилококка И П. aeruginosa Это было 5,0 и 4,6 соответственно. Эксперименты повторялись трижды.
Через 4 дня лечения комбинированное лечение иАМФ и антибиотиками привело к снижению на 1,63 log. Бактерии золотистого стафилококка Биопленки и уменьшение бревна в 2,13 П. aeruginosa Биопленки по сравнению с плацебо (с <0,0001). Напротив, по сравнению с плацебо, ни iAMF, ни монотерапия антибиотиками не оказали существенного влияния на КОЕ биопленок для обоих штаммов. По сравнению с монотерапией iAMF частота комбинированной терапии была еще более снижена. Бактерии золотистого стафилококка И П. aeruginosa КОЕ биопленки на 1,49 log и 2,34 log соответственно (с <0,0001). По сравнению с монотерапией антибиотиками, комбинированная терапия была еще более сокращена. Бактерии золотистого стафилококка И П. aeruginosa Биопленка КОЕ на 1,00 log (с = 0,0061) и 1,50 log (с = 0,0004) соответственно.
Влияние целевой температуры iAMF на сокращение биопленок КОЕ
После наблюдения бактерицидного действия одиночных импульсов АМФ при целевой температуре 75°C эффективность лечения была подтверждена при более низких температурах. Чтобы компенсировать падение температуры, было применено 12 импульсов AMF для достижения целевой пиковой температуры 65 °C и 24 импульса для целевой максимальной температуры 55 °C (рис. 4). Чтобы изучить влияние других антибиотиков в сочетании с иАМФ, активность рифампицина (50 мг/кг) изучали в… Бактерии золотистого стафилококка Биопленка.
Сокращение бактериального рекорда S. ауреус Биопленки после нагревания iAMF до различных температур (Tвыше ; N = 6, 9, 9 соответственно), назначение рифампина (50 мг/кг, РИФ; N = 5, 8, 8 соответственно) или комбинированной терапии иАМФ∙РИФ (иАМФ∙РИФ; N = 7, 8, 8 соответственно) по сравнению с фиктивным лечением (без ABX или iAMF; N = 6, 9, 8 соответственно). У животных, получавших iAMF, имплантаты нагревали до Tвыше л(а(55°С)Б(65°С, а)С)Один цикл при температуре 75°C в день. Столбики ошибок указывают SD. Важные результаты в с = 0,0007 (***) и <0,0001 (****) для сравнений, показанных с использованием однофакторного дисперсионного анализа с критерием множественных сравнений Тьюки. Эксперименты в (а) повторялось дважды и в (Б, С) повторялось три раза.
Комбинированная терапия снова показала улучшенные бактерицидные результаты по сравнению с эффектами монотерапии. Когда iAMF обрабатывали при 65°C и 75°C, комбинированное лечение iAMF-рифампицином снижало S. ауреусКОЕ биопленки на 1,35 и 1,76 log по сравнению с одним рифампином (с<0,0001). Однако комбинированная терапия при 55°C не показала существенной пользы по сравнению с монотерапией антибиотиками. По сравнению с нагревом iAMF, комбинированное лечение привело к значительно большему снижению Бактерии золотистого стафилококкаКОЕ биопленки при всех целевых температурах с сопоставимым логарифмическим снижением 2,43 (65°C; с<0,0001), 3,48 (75°С; с<0,0001) и 1,09 (55°С; с= 0,0007). По сравнению с плацебо комбинированное лечение привело к логарифмическому снижению КОЕ на 1,33, 2,76 и 3,37 при 55°C, 65°C и 75°C соответственно (с<0,0001). При сравнении монотерапии рифампицин был более эффективен в снижении КОЕ биопленок, чем один iAMF при всех протестированных температурах (с<0,0001) с логарифмическим снижением на 1,40, 1,07 и 1,72 по сравнению с iAMF при 55°C, 65°C и 75°C соответственно.
Влияние частоты дозирования iAMF на уменьшение биопленок КОЕ
Помимо регулировки целевой температуры и количества импульсов, изучались эффекты изменения частоты дозирования iAMF. мыши с П. aeruginosaИмплантаты, инфицированные биопленками, подвергались воздействию доз iAMF один раз каждые 24 часа или один раз каждые 12 часов в течение четырех дней при температуре 65°C (12 импульсов) или 75°C (1 импульс) отдельно в сочетании с ципрофлоксацином (20 мг/кг) или обработанный. только с ципрофлоксацином (рис. 5). Как и в случае с антибиотиками, iAMF проявлял дозозависимые эффекты с увеличением количества процедур iAMF, что приводило к дальнейшему снижению КОЕ в сочетании с антибиотиками. Этот эффект был особенно выражен при целевой температуре 75°C, где стратегия дозирования один раз каждые 12 часов приводила к логарифмическому снижению на 3,41 по сравнению с плацебо.с<0,0001). Однако монотерапия iAMF не привела к значительно большему снижению КОЕ при применении дважды по сравнению с один раз в день.
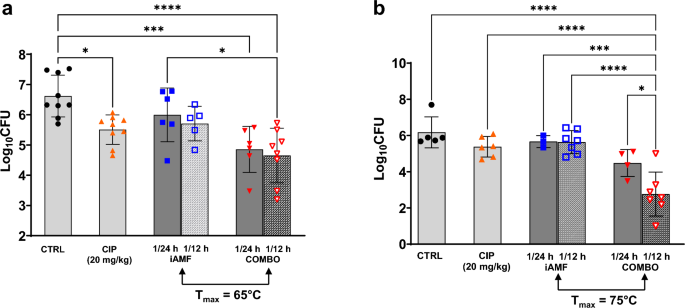
Бактериальное логарифмическое снижение PAO1 P. синегнойная палочкаБиопленка на имплантатах после лечения АМФ один раз в 24 часа или один раз в 12 часов в сочетании с ципрофлоксацином [CIP] При дозе 20 мг/кг (iAMF∙CIP), после введения только ципрофлоксацина 20 мг/кг (CIP) или после введения только iAMF в Т-имплантат.вышел(а(65°С, а)Б) Один цикл 75°C на дозу. Столбики ошибок указывают SD. Важные результаты в с= 0,0175-0,0287, 0,0006 (***, панель a), 0,0003 (***, панель b) и <0,0001 (****) для сравнений, показанных с использованием однофакторного дисперсионного анализа с тестом множественных сравнений Тьюки. Эксперименты в (а) повторялись трижды (N = 5–9) и (Б
) повторялись дважды (N = 3–7).
Гистопатологический анализ тканей, окружающих металлические шариковые имплантаты, обработанные iAMF.
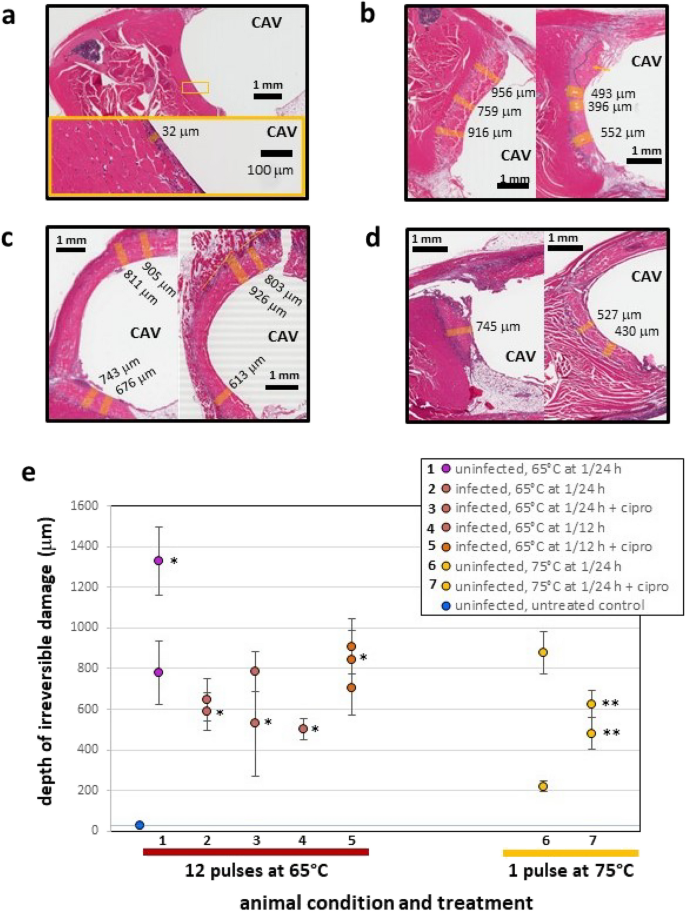
Рисунок 6Гистопатология мышечной ткани, контактирующей с нагретыми iAMF стальными шариковыми имплантатами от iAMF-инфицированных и неинфицированных мышей, получавших антибиотики или без них. Репрезентативные срезы тканей животных обрабатывали в течение 4 дней подряд в различных условиях. (а) Неповрежденная мышь, получавшая ложное лечение, с минимальным миофибриллярным некрозом и связанной с ним воспалительной реакцией в месте трансплантации. Клетки воспаления, возможно, нейтрофилы, распространяются в ткань примерно на 20–30 мм от края полости имплантата (КАВ). (Б) Неинфицированных мышей лечили iAMF (Tвыше= 75 °C) без (слева) или с (справа) ципрофлоксацина. (С) Лечение iAMF (Tвыше = 65 °C) инфицированная мышьП. aeruginosaНеинфицированную мышь (справа) лечили ципрофлоксацином (20 мг/кг, слева). (Доктор )П. aeruginosaМыши, инфицированные дозами iAMF (Tвыше= 65°C) каждые 12 часов в течение 1 дня (слева) и 4 дней (справа). Измерения глубины необратимого повреждения тканей (миофибриллярного некроза) от края КАВ обозначены оранжевыми полосами. (ЧАС
) Глубина необратимого повреждения тканей в зависимости от состояния мыши и лечения. Пронумерованы состояние и лечение каждого животного, включенного в легенду. Столбики ошибок указывают стандартное отклонение измерений отдельных животных. *Его лечили один день и усыпили. **Его лечили 7 дней подряд и подвергли эвтаназии. Репрезентативные образцы тканей (рис. 6b обрабатывались при 75°C, рис. 6c – при 65°C и рис. 6d – при 65°C с удвоенной частотой и общей дозой, как вС
) показывает миофасциальный некроз (необратимое повреждение) и воспаление вокруг места имплантата различной степени тяжести и глубины тканей. Измерения проводились в различных местах по периметру границы раздела имплантат-ткань, перпендикулярно краю полости, в областях, свободных от артефактов, возникших в результате хирургических процедур или обработки ткани. Эти области в основном располагались на проксимальной стороне бедренной кости или напротив нее и были выбраны как показатель повреждения тканей, в частности, из-за нагревания АМФ. Все животные были подвергнуты эвтаназии сразу после завершения лечения. При сравнении неповрежденных мышей, получавших только iAMF (рис. 6b, слева, при 75°C и рис. 6c, справа, при 65°C), измерения повреждения тканей, обработанных при 75°C, варьировались от 759 до 956 мкм от имплантата, в то время как ткань Измерения повреждений, обработанных при 65°C, варьировались от 613 до 926 микрометров, без существенной разницы между двумя наборами измерений.
В общей сложности измерения глубины некроза и воспаления были получены для 14 мышей, у которых можно было анализировать срезы тканей (рис. 6e). В общей сложности 48 выполненных измерений выявили среднее и стандартное отклонение 690±268 мкм повреждения ткани при всех условиях. Никаких существенных различий в средней глубине повреждения тканей в зависимости от пиковой температуры или частоты дозирования не наблюдалось. Для животных, получавших iAMF при 65°C один раз в день, средняя глубина повреждения тканей составляла 745±297 мкм (из n = 22 общих измерений для 6 мышей), тогда как для животных, получавших лечение при 65°C два раза в день, средняя глубина повреждения ткани повреждение составило 721 ± 193 мкм (по n = 14 измерениям для 4 мышей).

«Зомби-любитель-евангелист. Неизлечимый создатель. Гордый новатор в твиттере. Любитель еды. Интернетоголик. Жесткий интроверт».





More Stories
Советы по получению новой одежды Евы в «Stellar Blade»
Apple рассматривает важное решение, касающееся следующей версии iPhone: OpenAI или Gemini от Google.
Это круто! Microsoft и IBM с открытым исходным кодом MS-DOS 4.0